Alih Bahasa : Reza Ervani bin Asmanu
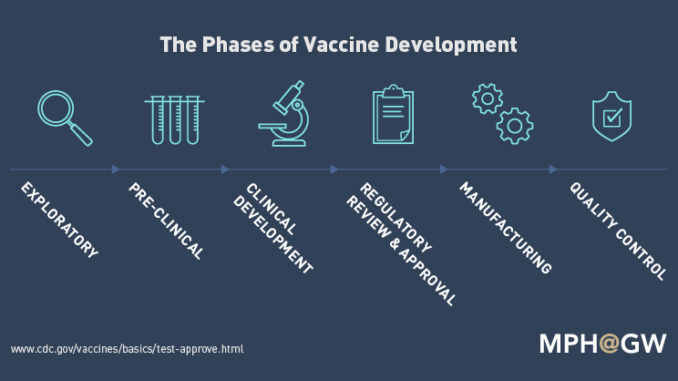
Fase Penyelidikan (Exploratory) :
Ini adalah fase riset intensif terkait proses pengembangan vaksin. Fase ini dirancang guna mengidentifikasi “antigen alami atau antigen sintetik yang dapat membantu mencegah atau mengobati penyakit”. Antigen dapat saja mengandung turunan (strain) dari virus tertentu yang sudah dilemahkan.
Fase Pra-Klinis :
Sepanjang fase ini, para peneliti – biasanya di industri swasta – melakukan sistem kultur-tisu atau kultur-sel serta melakukan pengujian pada hewan untuk menentukan apakah suatu kandidat vaksin akan menghasilkan imunitas.
Banyak kandidat vaksin yang tidak lulus ke tahap pengembangan berikutnya dikarenakan gagal menghasilkan imunitas atau membuat subjek tes menjadi celaka.
Fase Pengembangan Klinis (Clinical development):
Pada titik ini, sponsor, biasanya perusahaan swasta, mengajukan aplikasi untuk dilakukan Investigasi Obat Baru (Investigational New Drug – IND) ke U.S. Food and Drug Administration (FDA). Aplikasi berisi rangkuman tanggal penemuan vaksin dan deskripsi bagaimana vaksin akan dites dan dibuat.
Sebuah institusi yang akan menjadi tuan rumah pengujian klinis akan menunggu persetujuan aplikasi tersebut. FDA sendiri memiliki waktu 30 hari untuk menyetujui atau menolak aplikasi dimaksud.
Setelah proposal disetujui, vaksin harus kemudian lulus tiga tahap pengujian pada manusia
Fase I
Menguji kandidat vaksin ke kelompok kecil (kurang dari 100 orang) dengan tujuan menentukan apakah kandidat vaksin aman, serta untuk mempelajari lebih jauh respon yang muncul di kalangan subjek tes
Fase II
Tahap ini menyertakan ratusan subjek tes manusia, bertujuan untuk mendapatkan informasi lebih banyak tentang keamanan, imunogenisitas, rentang waktu imunisasi/kekebalan (immunization schedule) dan ukuran dosis.
Fase III
Fase ini dapat menyertakan ribuan atau bahkan puluhan ribu subjek tes, melanjutkan pengukuran keamanan (terutama karena efek samping terkadang tidak muncul di kelompok yang kecil) serta efektifitas kandidat vaksin
Fase Kajian dan persetujuan Regulator (Regulatory review and approval) :
Jika vaksin lulus tiga fase pengembangan klinis yang disebutkan sebelumnya, pengembang vaksin mendaftarkan Aplikasi Lisensi Biologis – Biologics License Application (BLA) ke FDA.
Produksi (Manufacturing) :
Manufaktur utama obat menyediakan infrastruktur, personil dan perangkat yang diperlukan untuk memproduksi massal vaksin. Mereka juga dapat menuai keuntungan dari kesuksesan dan tersebarnya vaksin secara luas.
Pengendalian Kualitas (Quality control) :
Persetujuan dan distribusi belumlah merupakan akhir dari proses. Stakeholder mestilah menyediakan prosedur yang memungkinkan mereka menjejaki apakah vaksin berfungsi sebagaimana yang diharapkan.
Sistem berlapis – termasuk Fase Ujicoba IV (penelitian opsional yang dapat dilakukan bersamaan dengan rilis vaksin), Sistem Pelaporan Kejadian Kegagalan Vaksin (Vaccine Adverse Event Reporting System – VAERS) dan Vaccine System Datalink – dirancang untuk memonitor performa, keamanan dan efektifitas vaksin yang telah disetujui.
Proses-proses ini, bagaimanapun, tidak dapat terjadi tanpa skill dan masukan dari berbagai stakeholder, mulai dari peneliti lab, pembuat kebijakan hingga tenaga medis profesional. (reza@rumahilmu.or.id)
Leave a Reply